Des scientifiques proposent une stratégie de greffage par électrochimie « click » de protéines à la surface de membranes virales, bactériennes ou cellulaires et qui jouent un rôle fondamental dans de nombreuses fonctions biologiques. Ces modifications de surface permettraient par exemple de conférer de nouvelles fonctions aux vecteurs viraux utilisés en thérapie génique ou aux cellules souches et immunitaires utilisées en thérapies cellulaires régénératives et anticancéreuses.
Les protéines à la surface des membranes bactériennes, cellulaires ou virales, jouent un rôle fondamental dans bon nombre de fonctions biologiques : adhérence, communication et identification cellulaire, transport de nutriments, adaptation à l’environnement…
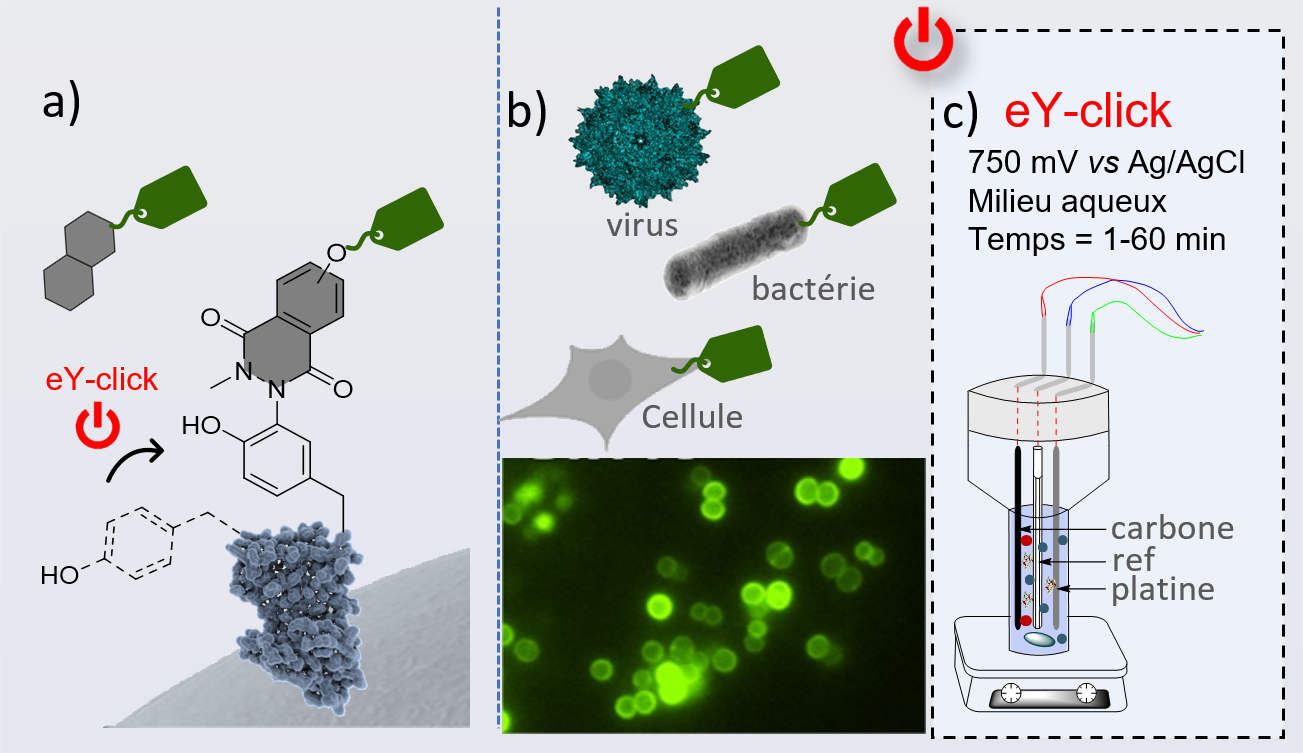
Agir sur ces protéines de surface, les modifier, permettrait de conférer de nouvelles propriétés aux vecteurs viraux utilisés en thérapie génique ou aux cellules souches et immunitaires utilisées en thérapies cellulaires régénératives et anticancéreuses. En effet, ces modifications pourraient permettre de diriger le tropisme naturel de ces entités vers les organes cibles pour délivrer un gène d’intérêt, des sondes chimiques ou des molécules cytotoxiques. Cette perspective justifie les efforts importants réalisés pour développer des méthodes efficaces et fiables de greffage moléculaire sur la surface de virus, de bactéries ou de cellules vivantes.
Actuellement, la méthode de choix reste l’expression d’un sucre présentant une « étiquette chimique » accessible à des réactions de chimie click. Elle nécessite toutefois de cultiver les bactéries/cellules pendant plusieurs heures/jours en présence du sucre modifié, comporte un taux d’incorporation de ces sucres variable selon les lignées cellulaires, et n’est pas applicable aux virus. Il est donc urgent de développer des méthodes alternatives permettant de s’affranchir de cette étape de bio-incorporation.
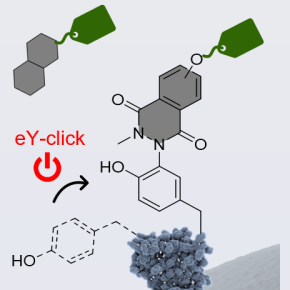
Des scientifiques des laboratoires Chimie et interdisciplinarité, synthèse, analyse, modélisation (CNRS/ Nantes Université), Translational Research in Gene Therapy (INSERM, Nantes Université) et Unité en sciences biologiques et biotechnologies (CNRS/ Nantes Université) sont parvenus à fonctionnaliser par électrochimie* la surface de vecteurs viraux, de bactéries et de cellules. Testée sur des virus adéno-associés recombinants (rAAV2) utilisés en thérapie génique, leur méthode de synthèse peut être réalisée en quelques minutes pour produire des vecteurs viraux fonctionnalisés qui conservent à la fois leur intégrité structurale et leur propriété infectieuse. Dans le cas de souches bactériennes d’Escherichia coli (Gram-) et de Staphyloccocus epidermidis (Gram+), ainsi que sur plusieurs lignées cellulaires eucaryotes, les scientifiques ont obtenu des bactéries et des cellules marquées sans impact sur leur viabilité, et qui conservent leur capacité à se diviser.
Cette méthode simple à mettre en œuvre, parue dans la revue Nat. Commun., devrait permettre d’optimiser la conception de vecteurs thérapeutiques viraux, bactériens et cellulaires.
(*) Les scientifiques ont utilisé des dérivés du N-méthyluminol (NML), une fonction d’ancrage aux protéines. La fonctionnalisation a été réalisée électrochimiquement et in situ en appliquant un potentiel électrique à des solutions aqueuses contenant du NML fonctionnalisé en présence de virus, de bactéries ou de cellules.
Référence
Depienne, S.; Bouzelha, M.; Courtois, E.; Pavageau, K.; Lalys, P-A.; Marchand, M.; Alvarez-Dorta, D.; Nedellec, S.; Marin-Fernandez, L.; Grandjean, C.; Boujtita, M.; Deniaud, D.; Mével, M. & Gouin, S.G.
Click-electrochemistry for the rapid labeling of virus, bacteria and cell surfaces
Nat. Commun., 2023, 14, 5122.
Contact
Sébastien Gouin
Chercheur au laboratoire Chimie et interdisciplinarité, synthèse, analyse, modélisation (CNRS/ Nantes Université)
sebastien.gouin@univ-nantes.fr
Mathieu Mével
Chercheur au laboratoire Translational Research in Gene Therapy (INSERM, Nantes Université)