20.05.2021, par Martin Koppe
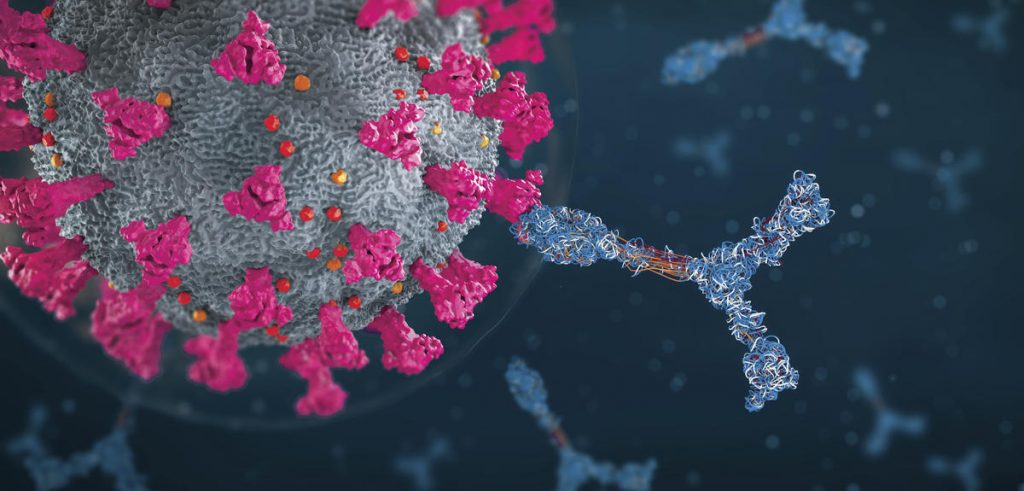
Comme les virus ne peuvent répliquer leur matériel génétique qu’en détournant la machinerie cellulaire, cibler cette étape cruciale peut stopper l’infection. Des chercheurs d’universités françaises et du CNRS se sont rassemblés au sein du projet Gavo, afin de synthétiser des molécules susceptibles de bloquer la réplication des virus à ARN comme celui du Covid-19.
Si de nombreux vaccins ont été proposés pour se protéger du Covid-19, nous manquons encore de médicaments adaptés pour guérir les patients déjà contaminés. SARS-CoV-2, comme tous les virus, est incapable de s’autorépliquer et a donc absolument besoin d’infecter un hôte et d’en détourner la machinerie cellulaire à son profit. Les cellules infectées se mettent alors à produire de nouveaux virus au détriment de leurs fonctions vitales. Si ce mode d’action fait la spécificité des virus, il représente également un point faible ciblé par les chercheurs : affecter ce processus freine, voire stoppe, la propagation des virus dans l’organisme.
Une piste prometteuse pour traiter plusieurs maladies
« Lorsqu’un virus entre dans une cellule, il y déverse les matériaux de base nécessaires à sa réplication, explique Jacques Lebreton, professeur à l’université de Nantes et membre du laboratoire Chimie et interdisciplinarité : synthèse, analyse, modélisation1 (Ceisam). Les virus à ARN libèrent ainsi des segments d’ARN qui sont ensuite traduits en protéines par les ribosomes de la cellule hôte. » Ces séquences d’ARN sont une succession de nucléotides, des molécules formées par l’association d’un sucre, d’un phosphate et d’une des quatre bases azotées propres à l’ARN : adénine, guanine, cytosine et uracile.Environ la moitié des médicaments contre des pathologies virales sont basés sur des dérivés de nucléosides.
« Pour combattre les virus, on peut tenter de bloquer la polymérase virale chargée de la réplication du matériel génétique du virus en incorporant à l’ARN viral un analogue de nucléosides (association d’un sucre et d’une base azotée, Ndlr), poursuit Jacques Lebreton. Bien choisie, la molécule factice empêche d’accrocher de nouveaux nucléosides au brin d’ARN, et donc de terminer la réplication du virus. Environ la moitié des médicaments contre des pathologies virales sont basés sur des dérivés de nucléosides. »
Les virus à ARN sont impliqués dans de nombreuses maladies : Ebola, hépatite C, poliomyélite, dengue, chikungunya, Zika mais aussi le Covid-19. L’emploi d’analogues de nucléosides est ainsi une des pistes les plus prometteuses pour des traitements ciblant le SARS-CoV-2. Pour plus d’efficacité, ces molécules doivent cependant être adaptées aux caractéristiques du virus. Chacun utilise en effet ses propres enzymes, appelées ARN polymérases, pour détourner la machinerie cellulaire. Si cela est parfois possible, il ne suffit pas toujours de piocher dans les molécules déjà connues, même si elles agissent contre d’autres pathologies.
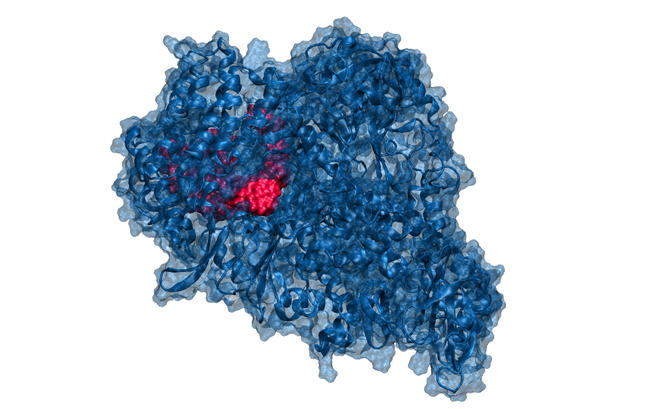
Le programme Gavo, pour Génération d’Anti-Viraux Originaux, a ainsi été bâti pour découvrir de futurs médicaments basés sur des nucléosides. Dans le contexte actuel, l’accent est mis sur le Covid-19, toutefois ces travaux concerneront plus généralement les virus à ARN et certains cancers. Le projet est porté par Jacques Lebreton et son collègue Arnaud Tessier, chargé de recherche CNRS au Ceisam.
« La France a eu par le passé un incroyable savoir-faire dans la chimie des nucléosides, et nous trouvions dommage qu’il se perde, regrette Jacques Lebreton. Pendant le premier confinement, nous avons contacté Jacques Maddaluno, directeur de l’Institut de chimie du CNRS, pour fédérer les équipes françaises travaillant dans ce domaine. Le ministère de l’Enseignement supérieur, de la Recherche et de l’innovation nous a ensuite soutenus financièrement pour mettre en place le programme Gavo. »
Synthèse et modélisation, deux approches complémentaires
Le projet réunit donc des chercheurs du Ceisam à Nantes, mais également d’autres laboratoires : l’Institut des biomolécules Max Mousseron2 à Montpellier, l’Institut de chimie organique et analytique3 à Orléans et le Laboratoire de physique et chimie théoriques4 à Nancy. Ces divers talents permettent de combiner deux approches en parallèle. La modélisation permet de comprendre pourquoi un composé donné peut bloquer l’action d’un enzyme et comment la structure de ce dernier pourrait être modifiée pour en augmenter l’efficacité.
La première consiste à synthétiser un grand nombre de dérivés de nucléosides pour constituer une véritable bibliothèque de molécules, dont les propriétés biologiques seront, dans la foulée, évaluées par ViroCrib à Montpellier. Cette plateforme, mise en place par le CNRS via l’Institut des sciences biologiques, va tester l’activité antivirale de ces analogues sur un large panel de virus. La seconde approche se base sur la modélisation, à l’échelle moléculaire, des processus impliqués dans la réplication de l’ARN viral, afin de prédire la structure des composés aptes à perturber, voire inhiber, le phénomène. Ce procédé offre alors des pistes aux chimistes, qui peuvent ensuite synthétiser ces molécules originales susceptibles de bloquer la réplication du virus.
« Notre expert en modélisation a par exemple analysé comment le remdesivir, un analogue de nucléosides breveté par Gilead Sciences contre le virus Ebola, s’accroche à la polymérase de SARS-CoV-2 en l’empêchant de glisser le long du brin d’ARN et donc de le reproduire, ajoute Jacques Lebreton. La modélisation permet de comprendre pourquoi un composé donné peut bloquer l’action d’un enzyme et comment la structure de ce dernier pourrait être modifiée pour en augmenter l’efficacité. Cela revient à trouver la bonne clé pour une serrure donnée. Notre collègue conçoit de manière rationnelle, et in silico, des solutions que nous essayons ensuite de synthétiser. Avec nos moyens limités par rapport aux géants pharmaceutiques, nous devons être astucieux pour identifier des molécules efficaces et spécifiques. »
Science Photo Library
Les chercheurs ont besoin d’être guidés dans le choix des transformations chimiques les plus pertinentes à réaliser, impliquant une expertise à la croisée de la chimie des sucres et de celle des hétérocycles. Les nucléosides sont en effet une classe de molécules complexes, offrant une quasi-infinité de modifications chimiques et leurs combinaisons. Le criblage des molécules, anciennes ou nouvelles, est ainsi crucial pour identifier une activité biologique donnée dans une telle multitude. L’AZT (Retrovir®), synthétisé et breveté en 1964 comme anticancéreux, avait par exemple été oublié du fait de piètres résultats. Vingt ans plus tard, cet analogue nucléosidique est revenu sur le devant de la scène quand son effet contre le VIH a été découvert lors d’une vaste campagne de criblage. « Avec tous les analogues de nucléosides qui ont été synthétisés depuis ces dernières décennies, nous pouvions penser trouver rapidement une solution thérapeutique efficace contre le Covid-19, rappelle Jacques Lebreton. Ça n’a malheureusement pas été le cas, même si le remdesivir a un temps apporté une lueur d’espoir. »
La synthèse de nouveaux analogues de nucléosides doit donc se poursuivre. Dans le cadre du projet Gavo, cette mission est renforcée par la présence d’experts en chimie en flux du laboratoire Chimie organique, bio-organique : réactivité et analyse5 à Rouen. Cette technologie récente permet de préparer en continu des molécules inédites, avec une grande variété de conditions opératoires. Curieusement, cette approche a jusqu’à présent été très peu utilisée pour la synthèse de nucléosides, alors qu’elle offre la possibilité d’aller au-delà des structures déjà connues. La chimie en flux tend également à être plus rapide que les méthodes conventionnelles.
Avec la mise en commun de leurs compétences, les chercheurs du programme Gavo vont pouvoir travailler en synergie. La modélisation guide les chimistes pour l’élaboration de molécules nucléosidiques originales et appropriées pour bloquer la réplication virale. Ces molécules seront testées contre le Covid-19 mais aussi sur d’autres virus connus ou émergents. Reste à attendre les premiers résultats.

